Bu yazı, antibiyotik direnci ve kanser gibi iki büyük küresel sağlık sorununu ve bu sorunlara çözüm olabilecek küçük ama güçlü molekülleri, yani terapötik peptitleri ele alıyor. Antimikrobiyal ve antikanser peptitlerin nasıl işlev gördüğünü, hangi özellikleriyle öne çıktıklarını ve biyoinformatik yaklaşımların bu alanda neden kritik olduğunu açıklıyor.
Yazan: Özlem Sağıroğlu
Antibiyotik direnci: Küresel bir tehdit
Antibiyotik direnci ve kanser, karşı karşıya olduğumuz en acil küresel sağlık problemleri arasında yer almaktadır. Antibiyotiklere karşı direnç oluşumu aslında bu ilaçların ilk kullanıldığı zamanlardan itibaren ortaya çıkmaya başlamış, antibiyotikler zamanla özellikle ESKAPE patojenleri (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa ve Enterobacter spp.) başta olmak üzere direnç geliştiren bakterilere karşı etkisiz kalmaya başlamıştır. Dünya Sağlık Örgütü de bu yükselen tehdite karşı antibiyotiklerin yerini alacak yeni antimikrobiyal moleküllere ihtiyaç olduğunu vurgulamaktadır.1,2
Kanser: Etkili ve seçici tedavi arayışı
Uzun süredir araştırılmasına ve hakkında kapsamlı çalışmalar yapılmasına rağmen, ne yazık ki birçok kanser türü için tamamen etkili bir tedavi yöntemi henüz geliştirilememiştir. Yaygın kullanılan kemoterapi ve radyoterapi gibi tedavi yaklaşımları her zaman başarılı olamamakta ve kanser hücreleriyle birlikte sağlıklı hücrelere de zarar verebilmektedir.3,4 Bu nedenle seçici olarak tümör hücrelerini hedef alabilecek, sağlıklı dokulara zarar vermeyecek yenilikçi tedavi yöntemlerine ihtiyaç vardır.4,5
Alternatif bir yaklaşım: Terapötik peptitlerin kullanımı
Son yıllarda hem antibiyotik direncine hem de kansere karşı kullanılabilecek küçük moleküller öne çıkıyor: Terapötik Peptitler.
Amino asitlerden oluşan uzun zincirlere protein, 2-50 amino asitten oluşan kısa zincirlere ise peptit adı verilir.6 Peptitler; hormon gibi haberci, antimikrobiyal savunucu, yapısal ya da tedavi edici molekül olarak farklı görevler üstlenebilirler. Yüksek seçicilik ve düşük toksisite ile doğal metabolik süreçleri taklit edebilirler.7 Yapılan çalışmalarda özellikle iki peptit türü oldukça öne çıkıyor: Antimikrobiyal ve Antikanser Peptitler.
Antimikrobiyal peptitler
Antimikrobiyal peptitler, bakteriler ve virüsler de dahil olmak üzere çok çeşitli patojenlere karşı savunma sağlayan, tüm canlı organizmalar tarafından üretilen kısa amino asit dizileridir.1,8 Genellikle 5-50 amino asitten oluşurlar ve mikroorganizma zarlarıyla etkileşimi kolaylaştıran, bol miktarda katyonik ve hidrofobik amino asit birimleri içerirler.1,8,9,10
Antikanser peptitler
Antikanser peptitler ise, kanser hücrelerine karşı seçici davranan ve toksik etki gösteren peptitlerdir. Bu kısa peptitler de antimikrobiyal peptitlere benzer olarak pozitif yüklü amino asit birimleri, hidrofobik amino asit birimleri içerirler.11 Bu peptitler, özellikle seçici davranmaları, toksik olmamaları ve direnç geliştirme ihtimallerinin düşük olması sebebiyle yeni tedavi yöntemleri için öne çıkan adaylardır.
Terapötik peptitlerin etki mekanizmaları
Antimikrobiyal peptitlerlerin hücre zarına etkisi iki ana etki mekanizması üzerinden incelenebilir: gözenek oluşturan modeller ve oluşturmayan modeller. Gözenek oluşturan modellerin başlıcaları barrel-stave ve toroidal por modelleridir. Barrel-stave modelinde, peptitler önce zara paralel dizilir, ardından dikey olarak lipid tabakasına gömülür. Hidrofobik kısımlar lipitlerle, hidrofilik kısımlar ise kanalın iç yüzeyiyle etkileşir. Böylece iyon kanallarına benzer kalıcı gözenekler oluşur. Toroidal por modelinde ise peptitler zara yine dikey olarak girer, fakat güçlü peptit-peptit etkileşimleri yoktur. Bunun yerine zar kıvrılarak gözeneklerin hem peptitlerden hem de lipid baş gruplarından oluşmasına yol açar. Bu gözenekler geçici ve dinamiktir; bazı peptitler bu süreçte hücre içine geçebilir. Her iki mekanizma da zarın elektriksel dengesini bozar, hücre içi dengeyi altüst eder ve sonuçta hücre ölümüne yol açar.
Antimikrobiyal peptitler belirgin gözenekler oluşturmadan da etki edebilir. Bunun önemli bir örneği carpet (halı) modelidir. Bu mekanizmada, peptitler membran yüzeyine paralel olarak hizalanır ve kritik bir konsantrasyona ulaştıklarında onu bir halı gibi kaplar. Bu, membranı dengesizleştirir ve çift katmanın misel benzeri parçalara ayrıldığı deterjan benzeri bir etkiye yol açar. Gözenek modellerinin aksine, halı modeli güçlü peptit-peptit etkileşimleri veya membran çekirdeğine derinlemesine yerleşme gerektirmez. Antimikrobiyal peptit aktivitesinin her zaman tek bir modelle açıklanamadığını belirtmek gerekir. Bazı durumlarda etki mekanizmaları aynı anda görülebilir ya da birbirini yakip edebilir. Örneğin, halı benzeri bir aşama toroidal gözenek oluşumundan önce gelebilir. Farklı deney koşulları veya membran modelleri de aynı peptit için birden fazla etki modu ortaya çıkarabilir.12 Bunun sonucunda hücre hızla ölür. Ayrıca bazı antimikrobiyal peptitler yalnızca zarla sınırlı kalmayıp DNA ve RNA’ya bağlanarak replikasyonu engelleyebilir veya enzim fonksiyonlarını bozabilir.13
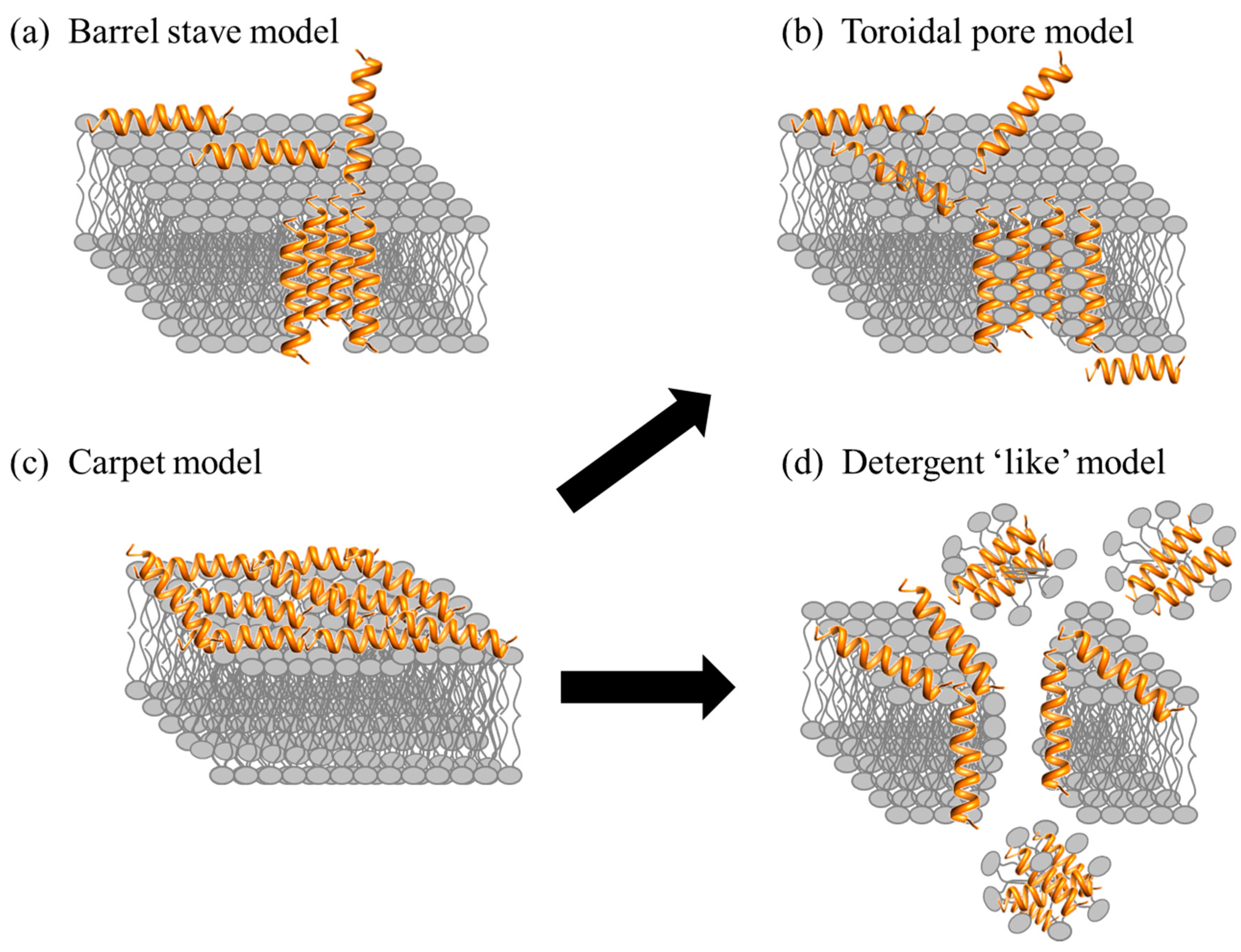
Şekil 1. Terapötik peptitlerin etki mekanizmaları12
Antikanser peptitler, çoğunlukla tümör hücrelerinin zarlarını hedefler. Bu seçicilik esas olarak kanser hücre zarlarının sağlıklı hücrelere göre daha negatif yüklü olmasından kaynaklanır. Antimikrobiyal peptitler için tanımlanan mekanizmalar (barrel-stave ve carpet modeli gibi) burada da geçerlidir. Antikanser peptitler mitokondriyal şişmeye, sitokrom c salınımına ve apoptoz yollarının aktivasyonuna da neden olabilirler. Kanser hücreleri ayrıca daha fazla mikrovillusa sahip olma eğilimindedir, bu da yüzey alanlarını artırır ve onları peptit bağlanması için daha kolay hedefler haline getirir. Diğer taraftan antikanser peptitler, sağlıklı hücrelerle zayıf hidrofobik temaslar yoluyla etkileşime girer. Kanser hücrelerinde ise güçlü elektrostatik çekimler baskındır, güçlü peptit etkileşimleri zarı dengesizleştirir ve seçici öldürmeye yol açar.9,11
Klinik kullanım ve güncel durum
Antimikrobiyal ve antikanser peptitler üzerine kapsamlı çalışmalar yapılsa da henüz bu özelliklere sahip olduğu gösterilmiş peptit sayısı halen sınırlıdır. Şu anda piyasada, musin, polimiksin B, vankomisin, baklofenasin, daptomisin ve diğerleri dahil olmak üzere 11 antimikrobiyal peptit ilacı bulunmaktadır.14 Kasım 2019 itibarıyla ise, FDA ve EMA tarafından 20'den fazla antikanser peptit onaylanmıştır.15 Peptit ilaçlarının sayıları her geçen gün artmaktadır: 1980 yılında onaylanan 10 peptit varken bu sayı 2010’da yaklaşık 30 peptite ulaşmıştır.7
İlaç geliştirme sürecindeki zorluklar
İlaç geliştirme süreci, yeni moleküllerin keşfinden klinik aşamalara kadar uzanan oldukça karmaşık bir yolculuktur. Bu süreçte, birçok aday molekül çeşitli nedenlerle başarısız olur; etkinlik göstermemesi, beklenmedik toksisite sergilemesi ya da klinik kriterleri karşılayamaması en sık karşılaşılan durumlardır. Bu nedenle ilaç keşfi, çoğunlukla hatalı veya uygun olmayan adayların elenmesiyle ilerleyen uzun ve zorlu bir süreçtir. Peptitlerin deneysel olarak tanımlanması, biyolojik aktivitelerinin test edilmesi ve moleküler özelliklerinin karakterize edilmesi oldukça zaman alıcı ve yoğun çalışmalar gerektirir. Dolayısıyla, her bir adayın laboratuvar ortamında tek tek test edilmesi hem araştırmacılar için ciddi iş gücü gerektirir, hem de yüksek maliyetlere yol açar. Bu noktada, deneysel çalışmalara geçmeden önce gerçekleştirilen hesaplamalı ön analizler kritik bir rol oynar. Hesaplamalı yöntemlerle yapılan bu ilk taramalar sayesinde, potansiyel olarak etkisiz ya da yüksek toksisite riski taşıyan adaylar elenebilir. Böylece araştırmacılar daha umut vadeden peptitlere odaklanabilir, süreç daha verimli hale gelir. Ayrıca, toksik etkilerin klinik öncesi aşamada öngörülmesi, güvenli ve etkili peptitlerin seçilmesinde önemli bir avantaj sağlar.7
Biyoinformatik yaklaşımların önemi
Özellikle aday molekül sayısının çok yüksek olduğu ve büyük veriyle çalışılan durumlarda, biyoinformatik araçların kullanılması süreci önemli ölçüde hızlandırır. Bu araçlar sayesinde binlerce hatta milyonlarca aday arasından ön eleme yapılabilir, düşük başarı şansı olan moleküller erken aşamada elenerek araştırmacıların daha umut vadeden adaylara odaklanması sağlanır. Böylelikle deneysel aşamaya geçmeden önce daha dar ve nitelikli bir aday havuzu elde edilir. Biyoinformatik analizler, yalnızca zaman kazandırmakla kalmaz; aynı zamanda araştırma süreçlerinde ortaya çıkacak maddi yükü de azaltır. Laboratuvar deneylerinin maliyetli ve emek yoğun doğası göz önünde bulundurulduğunda, hesaplamalı öngörülerle desteklenen bir ön değerlendirme yaklaşımı hem kaynakların daha verimli kullanılmasına hem de süreçlerin sürdürülebilir şekilde ilerlemesine katkı sağlar.
Antimikrobiyal ve antikanser peptit tahmin araçları da tam olarak bu işlevi yerine getirir. Aday peptit sayısının çok yüksek olduğu durumlarda bu araçlar, biyoinformatik tabanlı algoritmaları sayesinde kısa sürede büyük kütüphaneleri tarayabilir. Böylelikle etkinlik potansiyeli düşük olan peptitler erken aşamada elenir. Araştırmacılar, yalnızca daha yüksek başarı şansı taşıyan antikanser veya antimikrobiyal peptit adaylarına odaklanarak hem deneysel iş yükünü hem de maliyetleri azaltır. Bu tahmin araçları, deneysel doğrulama öncesinde güçlü bir filtre görevi görerek daha dar, nitelikli ve umut vadeden bir aday havuzunun oluşturulmasını sağlar.
Sonuç
Antimikrobiyal ve antikanser peptitler, günümüzün en kritik sağlık sorunları olan antibiyotik direnci ve kanserle mücadelede umut verici adaylar olarak öne çıkmaktadır. Yüksek seçicilikleri, düşük toksisiteleri ve direnç geliştirme ihtimallerinin düşük olması, onları geleneksel tedavilere alternatif kılmaktadır. Ancak peptitlerin keşfi ve geliştirilmesi, deneysel olarak oldukça zaman alıcı ve maliyetli bir süreçtir. Bu nedenle biyoinformatik yaklaşımlar, aday moleküllerin erken aşamada değerlendirilmesi ve ön elemeden geçirilmesi açısından vazgeçilmez hale gelmiştir.
Sonuç olarak, biyoinformatik araçlarla desteklenen sistematik araştırmalar hem antimikrobiyal hem de antikanser peptitlerin klinik uygulamalara kazandırılmasını hızlandıracak, böylece insanlığın karşı karşıya olduğu bu iki büyük sağlık problemine yenilikçi çözümler sunma potansiyelini artıracaktır.
Önümüzdeki yıllarda yapılacak araştırmalar, peptitlerin hem antibiyotik direncine hem de kansere karşı mücadelede nasıl bir dönüm noktası olacağını gösterecek.
Kaynaklar
1 Felício, M. R., Silva, O. N., Gonçalves, S., Santos, N. C., & Franco, O. L. (2017). Peptides with dual antimicrobial and anticancer activities. In Frontiers in Chemistry (Vol. 5, Issue Feb). Frontiers Media S. A. https://doi.org/10.3389/fchem.2017.00005
2 McKenna, M. (2013). Antibiotic resistance: The last resort. Nature, 499(7459), 394–396. https://doi.org/10.1038/499394A;SUBJMETA
3 Andrés, C. M. C., Pérez de la Lastra, J. M., Munguira, E. B., Andrés Juan, C., & Pérez-Lebeña, E. (2024). Dual-Action Therapeutics: DNA Alkylation and Antimicrobial Peptides for Cancer Therapy. In Cancers (Vol. 16, Issue 18). Multidisciplinary Digital Publishing Institute (MDPI). https://doi.org/10.3390/cancers16183123
4 Kang, T. H., Mao, C. P., He, L., Tsai, Y. C., Liu, K., La, V., Wu, T. C., & Hung, C. F. (2012). Tumor-Targeted Delivery of IL-2 by NKG2D Leads to Accumulation of Antigen-Specific CD8+ T Cells in the Tumor Loci and Enhanced Anti-Tumor Effects. PLOS ONE, 7(4), e35141. https://doi.org/10.1371/JOURNAL.PONE.0035141
5 Wu, D., Gao, Y., Qi, Y., Chen, L., Ma, Y., & Li, Y. (2014). Peptide-based cancer therapy: Opportunity and challenge. In Cancer Letters (Vol. 351, Issue 1, pp. 13–22). Elsevier Ireland Ltd. https://doi.org/10.1016/j.canlet.2014.05.002
6 Forbes, J., & Krishnamurthy, K. (2023). Biochemistry, Peptide. StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK562260/
7 Liscano, Y., Oñate-Garzón, J., & Delgado, J. P. (2020). Peptides with dual antimicrobial–anticancer activity: Strategies to overcome peptide limitations and rational design of anticancer peptides. In Molecules (Vol. 25, Issue 18). MDPI AG. https://doi.org/10.3390/molecules25184245
8 Tornesello, A. L., Borrelli, A., Buonaguro, L., Buonaguro, F. M., & Tornesello, M. L. (2020). Antimicrobial Peptides as Anticancer Agents: Functional Properties and Biological Activities. In Molecules (Vol. 25, Issue 12). MDPI AG. https://doi.org/10.3390/molecules25122850
9 Gaspar, D., Salomé Veiga, A., & Castanho, M. A. R. B. (2013). From antimicrobial to anticancer peptides. A review. Frontiers in Microbiology, 4(OCT), 63880. https://doi.org/10.3389/FMICB.2013.00294/FULL
10 Seo, M. D., Won, H. S., Kim, J. H., Mishig-Ochir, T., & Lee, B. J. (2012). Antimicrobial Peptides for Therapeutic Applications: A Review. Molecules 2012, Vol. 17, Pages 12276-12286, 17(10), 12276–12286. https://doi.org/10.3390/MOLECULES171012276
11 Chiangjong, W., Chutipongtanate, S., & Hongeng, S. (2020). Anticancer peptide: Physicochemical property, functional aspect and trend in clinical application (Review). International Journal of Oncology, 57(3), 678–696. https://doi.org/10.3892/IJO.2020.5099
12 Kumar, P., Kizhakkedathu, J. N., & Straus, S. K. (2018). Antimicrobial Peptides: Diversity, Mechanism of Action and Strategies to Improve the Activity and Biocompatibility In Vivo. Biomolecules 2018, Vol. 8, Page 4, 8(1), 4. https://doi.org/10.3390/BIOM8010004
13 Bechinger, B., & Gorr, S. U. (2017). Antimicrobial Peptides: Mechanisms of Action and Resistance. In Journal of Dental Research (Vol. 96, Issue 3, pp. 254–260). SAGE Publications Inc. https://doi.org/10.1177/0022034516679973
14 Zheng, S., Tu, Y., Li, B., Qu, G., Li, A., Peng, X., Li, S., & Shao, C. (2025). Antimicrobial peptide biological activity, delivery systems and clinical translation status and challenges. Journal of Translational Medicine, 23(1), 1–31. https://doi.org/10.1186/S12967-025-06321-9
15 Xie, M., Liu, D., & Yang, Y. (2020). Anti-cancer peptides: classification, mechanism of action, reconstruction and modification. Open Biology, 10(7), 200004. https://doi.org/10.1098/RSOB.200004



